Essai TRITON-CM : nucresiran dans l'amylose à transthyrétine - ATTR
L’essai TRITON-CM est une étude clinique internationale de phase 3 évaluant l’efficacité et la tolérance du nucresiran chez des patients atteints d’amylose à transthyrétine (ATTR) avec cardiomyopathie.
TRITON-CM compare le nucresiran au traitement de référence (Standard of Care – SoC) utilisé dans chaque pays participant, incluant principalement le tafamidis, l’acoramidis, ou un placebo dans de rares pays où aucun traitement spécifique n’est disponible.
L’objectif global est d’inclure 1 250 patients, randomisés selon un ratio 2:1 (2 patients recevant le nucresiran pour 1 patient recevant le traitement de référence).
Objectif de l’étude
L’objectif principal de TRITON-CM est d’évaluer si le nucresiran permet d’améliorer l’évolution clinique des patients atteints de d »amylose à transthyrétine, en comparaison au traitement de référence, tout en évaluant sa sécurité d’emploi.
Le traitement à l’étude : le nucresiran
Le nucresiran est un ARN interférent (ARNi) de dernière génération, conçu pour réduire la production de la transthyrétine (TTR), protéine responsable de la formation des dépôts amyloïdes.
Les résultats de la phase 1, à la dose de 300 mg retenue pour la phase 3, ont montré :
- Une réduction de plus de 90 % de la TTR circulante
- Une faible variabilité interindividuelle de la réponse
- La possibilité d’un espacement des injections à une administration tous les 6 mois, améliorant le confort et l’adhésion des patients.
Schéma de l’étude
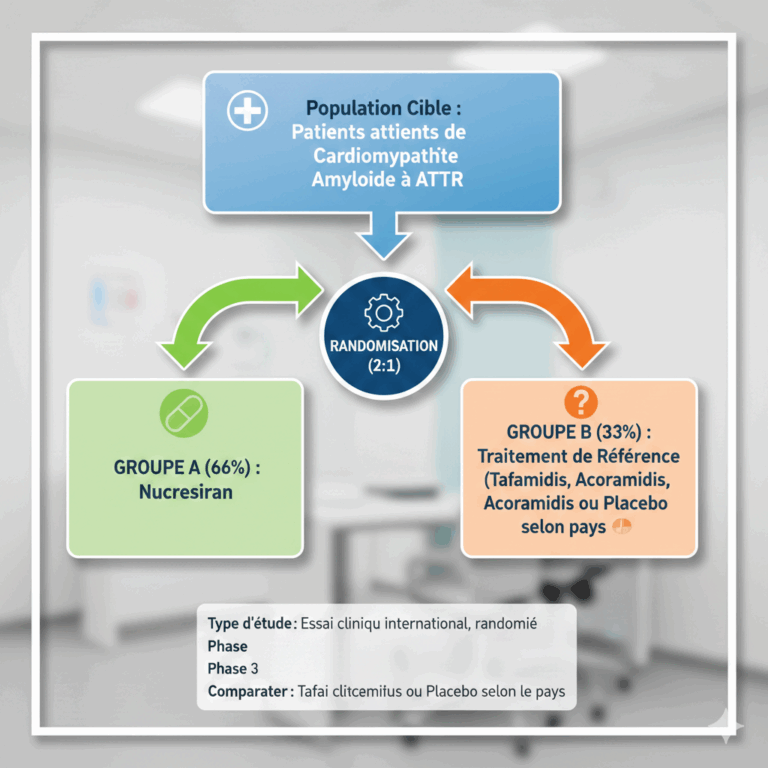
Principaux critères d’inclusion
Les principaux critères d’inclusion comprennent :
- Âge compris entre 18 et 85 ans
- Diagnostic documenté d’amylose à transthyrétine (ATTR) avec atteinte cardiaque
- Forme héréditaire ou sauvage
- Antécédents médicaux d’insuffisance cardiaque, définis par :
- Au moins une hospitalisation antérieure pour insuffisance cardiaque ou
- Des signes cliniques d’insuffisance cardiaque (avec ou sans hospitalisation) nécessitant un traitement par diurétique
À ce stade, le traitement requis repose principalement sur les diurétiques de l’anse, avec une évolution attendue des critères pour inclure notamment les inhibiteurs de SGLT2 (ISGLT2).
Centres investigateurs en France
L’étude TRITON-CM est conduite dans de nombreux centres experts français, avec les investigateurs principaux suivants :
CHU de Toulouse – Hôpital de Rangueil : Olivier LAIREZ (ouvert)
CHU de Rouen – Hôpital Charles-Nicolle : Charles FAUVEL (ouvert)
CHU de Nantes – Hôpital Nord Laennec : Nicolas PIRIOU (ouvert)
CHU de Rennes – Hôpital Pontchaillou : Erwan DONAL (ouvert)
CHRU de Tours – Hôpital Trousseau : Anne BERNARD (ouvert)
CHU de Montpellier – Hôpital Arnaud de Villeneuve : François ROUBILLE (ouvert)
CHU de Bordeaux – Hôpital Haut-Lévêque : Patricia RÉANT (ouvert)
AP-HM – Hôpital de la Timone : Gilbert HABIB (ouvert)
CHU Grenoble Alpes – Hôpital Michallon : Gilles BARONE-ROCHETTE (ouvert)
CHU de Reims – Hôpital Robert-Debré : Jérôme COSTA (ouvert)
AP-HP – Hôpital Bichat – Claude-Bernard : Vincent ALGALARRONDO (prévu mi-février)
CHU de Martinique : Astrid MONFORT (prévu mi-février)
AP-HP – Hôpital Européen Georges-Pompidou : Albert HAGEGE (prévu mi-février)
AP-HP – Hôpital Henri-Mondor : Thibaud DAMY (prévu fin février)
CHU Dijon Bourgogne – Hôpital François-Mitterrand : Romain DIDIER (prévu fin février)
CHU de Strasbourg – Nouvel Hôpital Civil : Jean-Jacques VON HUNOLSTEIN (prévu fin février)
L’essai TRITON-CM représente une étape majeure dans le développement de nouvelles stratégies thérapeutiques pour l’amylose à transthyrétine. Grâce à une réduction marquée et prolongée de la TTR, le nucresiran pourrait constituer une avancée significative pour les patients, tout en simplifiant le schéma d’administration.
Pour toute question, il est recommandé de contacter l’un des centres investigateurs.
